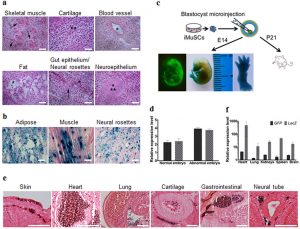
| To clarify the pluripotent potential of the iMuSCs, we performed differentiation assays6,7 in vitro that showed that the iMuSCs were able to form embryoid bodies (EBs) in a petri dish (Fig. 3d,e). After seven days in suspension culture, EBs were expanded and initiated spontaneous differentiation into a variety of ectodermal and mesodermal germ layer derivatives, and after an additional two weeks in culture, attached EBs formed contracting multinucleated myotubes encompassed with neural-like structures (Fig. 3f,g). We further examined the pluripotency of the iMuSCs by teratoma formation in vivo. When grafted into SCID-beige mice (Jackson Lab, USA) for seven weeks, the iMuSCs formed teratomas (90%, n = 7) containing representative tissues of the three germ layers (Fig. 4a). Histological examination revealed that the iMuSCs differentiated into neural, muscle, and adipose tissues, and epithelium. To verify that the teratomas were formed directly from the implanted cells, the iMuSCs were pre-labelled with β-gal before injection, we detected all three germ layer derivatives in the teratomas contained the β-gal+ cells when stained with LacZ (Fig. 4b).
To evaluate whether the iMuSCs could give rise to chimeric mice, a blastocyst injection assay was performed (Fig. 4c). We transferred undifferentiated β-gal+ and GFP-pre-labelled iMuSCs as single cells into BALB/c (Jackson Lab, USA) blastocysts by microinjection following standard procedures8. We obtained eight embryos at E14, six of which developed properly and demonstrated the contribution of GFP+ iMuSCs to the embryo. A high-to-moderate contribution of β-gal and GFP-expressing cells could be seen in these E14 chimeric embryos (Fig. 4c,d and Supplementary Fig. S4a). Histological analysis confirmed that the iMuSCs contributed to all three germ layers (Fig. 4e and Supplementary Fig. S4b). Offspring derived from the iMuSCs-injected blastocysts were born and developed normally. After repeating this experiment 3 times, we obtained 23 pups, all born with a white coat (Supplementary Table S1). Although their hair did not display iMuSCs germline transmission, immunostaining and qPCR analysis revealed the presence of LacZ+ and GFP+ iMuSCs in several tissues of the pups, such as skin, muscle, heart, lung, kidneys, spleen, and brain (Fig. 4f and Supplementary Fig. S4c). |